↓bottom↓
3B - FISICA a.s. 2025-26
 ...
...
«Ha a che fare con la curiosità.
Ha a che fare con gente che si chiede il meccanismo delle cose.
E ... se provi a cercare le risposte, scopri che sono tutte legate tra loro...
che le ceratteristiche comuni si rivelano sempre più universali.
Quello che stiamo cercando è come funziona tutto quanto,
cosa fa funzionare tutto quanto.» (Richard Feynman, USA 1918-1988)
 profili GeoGebra 3B (link)
profili GeoGebra 3B (link)

 elenco di possibili domande di teoria (pdf)
elenco di possibili domande di teoria (pdf)
 VideoEsperimenti di fisica 3░ ANNO
VideoEsperimenti di fisica 3░ ANNO
 la stella nascosta di Samuel Loyd (ovvero il segreto della MATEMATICA)
la stella nascosta di Samuel Loyd (ovvero il segreto della MATEMATICA)
 rappresentazione cronologica dell'ECUMENE (ovvero il segreto della FISICA)
rappresentazione cronologica dell'ECUMENE (ovvero il segreto della FISICA)
GOOGLE CLASSROOM: codice corso 3B FISICA: a2nhaj6
(utilizzare le credenziali di Google Suite già fornite dal liceo - tutorial come iscriversi)
LAVORO ed ENERGIA - cap.3 (vol.1)
«Se vuoi scoprire i segreti dell'universo, pensa in termini di energia, frequenza e vibrazione» Nikola Tesla  ...
...
 1. il LAVORO di una FORZA
1. il LAVORO di una FORZA
una UNITA' di MISURA per il lavoro: il joule
[J] = [N·m]
in onore di James JOULE (UK, 1818-1889)
 ...
...
il lavoro di 1J serve a sollevare un peso di 1N (circa 102gr) di 1m
 il LAVORO di una FORZA VARIABILE
il LAVORO di una FORZA VARIABILE
 2. la POTENZA
2. la POTENZA
una nuova UNITA' di MISURA per la potenza: il watt
[W] = [J/s]
in onore di James WATT (UK, 1791-1867)
 ...
...
 3. ENERGIA CINETICA
3. ENERGIA CINETICA  ...
...
 4. Forze conservative ed ENERGIA POTENZIALE
4. Forze conservative ed ENERGIA POTENZIALE
 5. la CONSERVAZIONE dell'ENERGIA MECCANICA
5. la CONSERVAZIONE dell'ENERGIA MECCANICA  ...
...
- - -
Per preparare la VERIFICA:
 FORMULARIO LAVORO ed ENERGIA (pdf)
FORMULARIO LAVORO ed ENERGIA (pdf)
 TEST1: sulle unità di misura della dinamica (link)
TEST1: sulle unità di misura della dinamica (link)

 ZANICHELLI TEST allenamento sul LAVORO ed ENERGIA (link)
ZANICHELLI TEST allenamento sul LAVORO ed ENERGIA (link)

 Esercitazione sul LAVORO ed ENERGIA - soluzioni (pdf)
Esercitazione sul LAVORO ed ENERGIA - soluzioni (pdf) 
- - -
↓bottom↓
↑top↑
Applicazione dei principi della dinamica - cap.2
RIPASSO:
 i principi della dinamica RIPASSO e RICHIAMI
i principi della dinamica RIPASSO e RICHIAMI
 Principio di composizione dei moti galileiano
Principio di composizione dei moti galileiano  ...
...
- - -
i sistemi NON inerziali e le FORZE APPARENTI
in un sistema di riferimento NON inerziale NON vale il principio d'INERZIA
"si chiama FORZA APPARENTE o FITTIZIA, una forza che non è prodotta da una interazione fisica, ma che si osserva in un sistema di riferimento NON inerziale a causa della accelerazione del sistema stesso" (pag.74)
si potrebbe dire che le forze apparenti sono forze che "APPAIONO" solo se mi trovo in un sistema di riferimento NON inerziale
 la Terra è un sistema di riferimento inerziale?
la Terra è un sistema di riferimento inerziale?  ...
...
- - -
di seguito consideriamo le seguenti FORZE APPARENTI:
 1 - il PESO "APPARENTE"
1 - il PESO "APPARENTE" 
 2 - la FORZA CENTRIFUGA
2 - la FORZA CENTRIFUGA 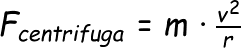
 ...
...
 3 - la FORZA di CORIOLIS
3 - la FORZA di CORIOLIS 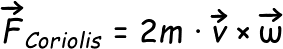
 ...
...
↓bottom↓
↑top↑
la Quantità di Moto - cap.4
 1. Impulso e Quantità di Moto
1. Impulso e Quantità di Moto
 2. URTI
2. URTI
 3. il PENDOLO BALISTICO
3. il PENDOLO BALISTICO
 4. il moto del CENTRO di MASSA
4. il moto del CENTRO di MASSA
- - -
Per preparare la VERIFICA:
 FORMULARIO Impulso, quantità di moto e urti (pdf)
FORMULARIO Impulso, quantità di moto e urti (pdf)
 Laboratorio URTI (PHET)
Laboratorio URTI (PHET)
 TEST2: sulle unità di misura della dinamica (link)
TEST2: sulle unità di misura della dinamica (link)

 Esercitazione Applicazioni principi della dinamica e Quantità di moto (cap.2 e 4) - soluzioni (pdf)
Esercitazione Applicazioni principi della dinamica e Quantità di moto (cap.2 e 4) - soluzioni (pdf) 
↓bottom↓
↑top↑
la GRAVITAZIONE - cap.6
«È opinione comune che la terra stia ferma;
ma Filolao Pitagorico dice che gira intorno al fuoco secondo un circolo obliquo, così come il sole e la luna.
Eraclide Pontico ed Ecfanto Pitagorico fanno muovere la terra, non però di moto traslatorio, ma rotatorio, infilata in un asse a guida di ruota e girante intorno al proprio centro da occidente a oriente»
PLUTARCO, De placitis philosophorum, III, cap. 1,3 (I sec.D.C.)
 1. lo studio del cielo nell'età classica (Tolomeo - Aristarco)
1. lo studio del cielo nell'età classica (Tolomeo - Aristarco)  ...
...
lo studio del cielo prima del cannocchiale
«L'astronomia non nasce col telescopio, nasce con la matematica...»
 2. COPERNICO (Pl, 1473-1543) e il problema del calendario
2. COPERNICO (Pl, 1473-1543) e il problema del calendario  ...
...
 3. TYCHO BRAHE (Dk, 1546-1601), l'astrologo
3. TYCHO BRAHE (Dk, 1546-1601), l'astrologo  ...
...
 4. KEPLERO (De, 1571-1631), l'astronomo miope e senza cannocchiale
4. KEPLERO (De, 1571-1631), l'astronomo miope e senza cannocchiale  ...
...
lo studio del cielo CON il cannocchiale:
 5. GALILEO: lo studio del cielo con il canna-occhiale
5. GALILEO: lo studio del cielo con il canna-occhiale  ...
...
 SISTEMA SOLARE raccolta di notizie dati e curiosità sul sistema solare
SISTEMA SOLARE raccolta di notizie dati e curiosità sul sistema solare
 6. NEWTON: la legge di gravitazione universale
6. NEWTON: la legge di gravitazione universale  ...
...
 7. Satelliti "GeoStazionari" e assenza apparente di gravitÓ
7. Satelliti "GeoStazionari" e assenza apparente di gravitÓ
 8. La Velocità di fuga e le "STELLE NERE " di MICHELL
8. La Velocità di fuga e le "STELLE NERE " di MICHELL
- - -
Considerazioni interdisciplinari
 La più sublime, la più nobile tra le Fisiche scienze è senza dubbio l'Astronomia. L'uomo s'innalza per mezzo di essa come al di sopra di sé medesimo, e giunge a capire la causa dei fenomeni più straordinari. (Giacomo Leopardi)
La più sublime, la più nobile tra le Fisiche scienze è senza dubbio l'Astronomia. L'uomo s'innalza per mezzo di essa come al di sopra di sé medesimo, e giunge a capire la causa dei fenomeni più straordinari. (Giacomo Leopardi)
Non sono stato in grado di scoprire le cause di tali proprietà della gravità, e non avanzo ipotesi (Hypotheses non fingo ) [...] è sufficiente che la gravità esista ed agisca secondo le leggi che ho spiegato e che sia in grado di rendere conto di tutti i moti dei corpi celesti
(Sir Isaac Newton)
- - -
materiali per preparare la VERIFICA
 Tabella dati Sistema Solare per esercitazione (pdf)
Tabella dati Sistema Solare per esercitazione (pdf)

 ZANICHELLI TEST allenamento sulla legge di gravitazione universale (link)
ZANICHELLI TEST allenamento sulla legge di gravitazione universale (link)

 ESERCITAZIONE sulla gravitazione (pdf)
ESERCITAZIONE sulla gravitazione (pdf)
...
TERMODINAMICA
- - -
La TEORIA CINETICA dei GAS (cap.8)
 1. premessa storica e richiami di Termologia e di chimica
1. premessa storica e richiami di Termologia e di chimica
- - - - - - - - - -
 2. le VARIABILI di STATO di un sistema termodinamico
2. le VARIABILI di STATO di un sistema termodinamico
 un esercizio interattivo sulla temperatura KELVIN (link)
un esercizio interattivo sulla temperatura KELVIN (link)
- - - - - - - - - -
 3. EQUAZIONE di STATO di un gas perfetto
3. EQUAZIONE di STATO di un gas perfetto
 un esercizio interattivo sulla legge dei gas perfetti (link)
un esercizio interattivo sulla legge dei gas perfetti (link)
 un esercizio interattivo sul piano PV (link)
un esercizio interattivo sul piano PV (link)
 Benjamin Thompson conte RUMFORD (USA,1753-1814)
Benjamin Thompson conte RUMFORD (USA,1753-1814)  ...
...
 la TEORIA CINETICA DEI GAS
la TEORIA CINETICA DEI GAS
 James JOULE (UK,1818-1889)
James JOULE (UK,1818-1889)  ...
...
- - -
per preparare la verifica

 ZANICHELLI TEST allenamento sulle leggi dei gas ideali (esclusi esercizi su teoria cinetica dei gas e diffusione)
ZANICHELLI TEST allenamento sulle leggi dei gas ideali (esclusi esercizi su teoria cinetica dei gas e diffusione)

 ESERCITAZIONE Termodinamica 1 (pdf) - Soluzioni (pdf)
ESERCITAZIONE Termodinamica 1 (pdf) - Soluzioni (pdf) 
↓bottom↓
↑top↑
- - -
↑top↑

