↓bottom↓
il SECONDO PRINCIPIO della TERMODINAMICA (cap.8)
«La lotta generale per l'esistenza degli esseri viventi non è una lotta per l'energia, ma è una lotta per l'entropia.»
Ludwig Boltzmann  ...
...

la MERIDIANA nel chiostro del convento di SAN BERNARDINO a TRENTO recita:
TU NUMERAS HORAS SED NECAT NOVISSIMA
ma cosa hanno in comune l'entropia, Boltzmann e frati di San Bernardino???
- - -
PREMESSA 1: NON SI PUO' SCONFIGGERE il SECONDO PRINCIPIO della TERMODINAMICA, si può perdere o al più pareggiare!
PREMESSA 2: MA SE L'ENERGIA SI CONSERVA (Primo Principio della Termodinamica) DOVE SAREBBE IL "PROBLEMA ENERGETICO"?
PREMESSA 3: "ENERGIA" deriva dal greco: "capacità di agire". Tradotto in fisica: "capacità di compiere LAVORO"
 la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
DEFINIZIONI:
- TERMODINAMICA: studio delle trasformazioni di energia nelle sue varie forme
- SISTEMA: quantità di materia separata da ciò che la circonda
- AMBIENTE: tutto ciò che è esterno al sistema
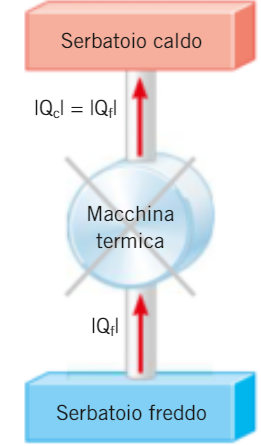
- una MACCHINA TERMICA è un dispositivo che trasforma l'energia interna dei corpi in lavoro meccanico mediante trasformazioni cicliche di un sistema termodinamico
- il RENDIMENTO di una macchina termica è il rapporto tra lavoro compiuto L e calore assorbito QC misurati durante un ciclo
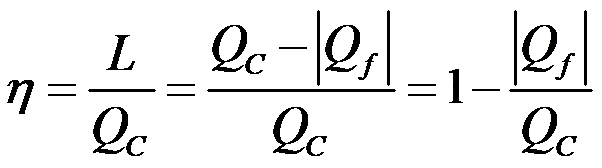
(in queste notazioni f sta per freddo e c sta per caldo)
SCHEMA di una qualsiasi MACCHINA TERMICA:
enunciato del secondo principio della Termodinamica:
 ... ... |
 Enunciato di Lord KELVIN (William Thomson, UK, 1824-1907): Enunciato di Lord KELVIN (William Thomson, UK, 1824-1907):
“È IMPOSSIBILE realizzare una trasformazione il cui UNICO risultato sia quello di convertire in lavoro del calore sottratto a un'unica sorgente a temperatura uniforme”(ad es. dal mare)
|
 ... ... |
enunciato di CLAUSIUS (Rudolf CLAUSIUS, DE, 1822-1888)
“È IMPOSSIBILE realizzare una trasformazione il cui UNICO risultato sia il passaggio di calore da un corpo più freddo a uno più caldo senza l’apporto di lavoro esterno” |
| si potrebbe equivalentemente enunciare: "in un sistema energeticamente isolato tutte le differenze di temperatura tendono ad annullarsi spontaneamente" | |
oppure: "in un sistema energeticamente isolato a temperatura uniforme non si possono spontaneamente creare differenze di potenziale termico tra diverse regioni" di conseguenza è necessario consumare energia per raffredare un ambiente come l'interno di un frigorifero o l'interno di una stanza con un climatizzatore |
|
╚ possibile trasferire CALORE da un corpo FREDDO ad uno CALDO? |
|
RAFFREDDARE la stanza APRENDO il FRIGORIFERO?
|
Macchine termiche frigorifere (Gianlorenzo Bussetti)
↓bottom↓
↑top↑
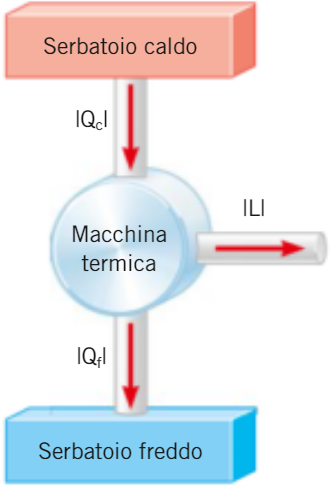
conseguenze del secondo principio della Termodinamica:
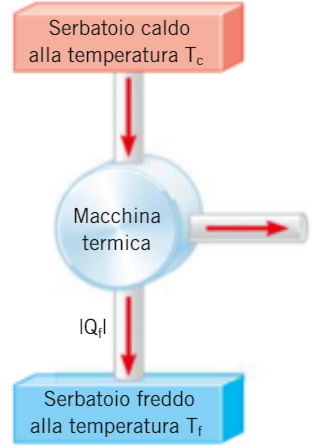
1. È IMPOSSIBILE far passare calore da un corpo più freddo a uno più caldo senza compiere lavoro (enunciato di CLAUSIUS) 2. È IMPOSSIBILE trasformare tutto il calore in lavoro (enunciato di KELVIN) 3. È IMPOSSIBILE costruire una macchina termica con rendimento η=1 (teorema di CARNOT)
infatti la macchina deve necessariamente operare tra due termostati a uno dei quali cedere il calore Qf che non può essere nullo (in queste notazioni f sta per freddo e c sta per caldo) di fatto le macchine termiche reali difficilmente raggiungono rendimenti superiori al 50%, è necessario quindi individuare le condizioni che assicurano il maggior rendimento possibile, per far questo si definisce: una trasformazione è detta reversibile se, a partire dallo stato finale, è possibile riportare sia il sistema sia l'ambiente con cui interagisce ai rispettivi stati iniziali in generale una trasformazione è reversibile se: N.B. le trasformazioni reali sono tutte irreversibili (ad esempio...)
quali trasformazioni MECCANICHE studiate sono REVERSIBILI e quali IRREVERSIBILI?
|
|
|
|
TEOREMA di CARNOT: (Sadi Carnot, Fr, 1796-1832)
tutte le macchine termiche REVERSIBILI, operanti tra le temperature Tc e Tf, hanno lo stesso rendimento ηrev e nessuna macchina reale (=irreversibile), operante fra le stesse temperature può avere un rendimento ηirrev maggiore, ossiaηrev ≥ ηirrev
conseguenze del teorema di Carnot: Il rendimento di una macchina di Carnot (detta anche macchina ideale o macchina reversibile) che opera tra le temperature Tc e Tf è dato da (dove le temperature sono espresse in gradi Kelvin):
|
4. È IMPOSSIBILE raggiungere lo ZERO ASSOLUTO mediante un numero finito di trasformazioni termodinamiche o Terzo principio della TermodinamicaInfatti se, PER ASSURDO, una macchina termica potesse operare tra una sorgente TC e Tf=0K si potrebbe avere una macchina con rendimento pari ad 1
|
|
5. È IMPOSSIBILE realizzare il moto perpetuo infatti il moto perpetuo di prima specie è in aperta violazione del primo principio della Termodinamica
|
↓bottom↓
↑top↑
l'ENTROPIA
la grandezza più intrigante della fisica
avendo osservato che: nel 1865 Rudolf CLAUSIUS ritenne di introdurre una nuova FUNZIONE di STATO: l'ENTROPIA "ENTROPIA" dal greco: "TRASFORMAZIONE INTERNA" scrive Clausius: “ho voluto intenzionalmente adottare il termine entropia per rimanere il più vicino possibile alla parola energia, in quanto le due grandezze … sono così affini in senso fisico che anche nella definizione questo accostamento pare opportuno” secondo Clausius il comportamento asimmetrico del calore rappresentava due diversi tipi di cambiamento: uno era un cambiamento di temperatura (energia termica che passava dal caldo al freddo), l’altro era un cambiamento di energia (energia meccanica che si trasformava in energia termica per attrito) e concluse che queste variazioni erano due aspetti dello stesso fenomeno: variazioni di ENTROPIA. Dunque per le applicazioni è necessario calcolare le variazioni di ENTROPIA di un sistema, (l’entropia non è misurabile direttamente) così definite: Se in un sistema avviene una trasformazione tra due stati, la variazione di entropia ΔS del sistema è pari al rapporto tra il calore scambiato dal sistema (con il suo segno) e la temperatura assoluta a cui viene scambiato lungo una qualsiasi trasformazione reversibile che congliunge i due stati: 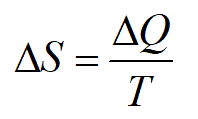
[l'ENTROPIA si misura in J/K] 1. Da questa definizione l’ENTROPIA dipende non solo dagli scambi di energia, ma anche dalla Temperatura 2. In una trasformazione ADIABATICA, reversibile, la variazione di ENTROPIA è zero ΔS=0 , infatti ΔQ=0
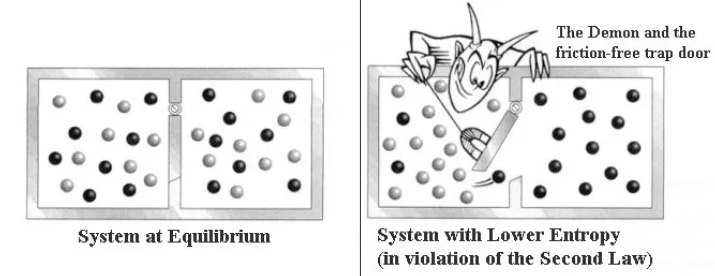
Clausius sosteneva che tutte le variazioni di carattere naturale (variazioni di energia e temperatura che si verificano spontaneamente in natura come ad esempio il fluire di calore dal corpo più caldo al più freddo o la trasformazione di energia in calore per attrito) sarebbero state considerate variazioni positive (=entropia in aumento); mentre tutte le variazioni innaturali (tutte le variazioni di energia e temperatura che si verificano quando la natura è sollecitata da una macchina) sarebbero state considerate variazioni entropiche negative. Egli giunse alla conclusione che tutti gli scambi di entropia positiva e negativa che si verificano nella totalità delle macchine esistenti nell’universo avevano sempre l’effetto di aumentare l’entropia. Il nostro universo è popolato da macchine imperfette, fossero queste animate e minuscole come le cellule del corpo umano o inanimate e gigantesche come le galassie. Nel nostro universo l’energia totale si conserva, ma l’ENTROPIA PUÒ SOLO AUMENTARE o al più restare invariata contro il 2° Principio della Termodinamica, si può solo perdere o al più pareggiare....
dunque tutto l’universo invecchierà e morirà una volta che tutti i suoi fenomeni naturali irreversibili si saranno completamente esauriti, quando cioè non ci saranno più due sorgenti di calore a temperature differenti, ma tutto l’universo si troverà alla stessa temperatura e le trasformazioni spontanee non saranno più possibili (cfr.enunciato di KELVIN) - Il 2° principio diventa dunque una formulazione del principio di NON conservazione dell’ENTROPIA la degradazione dell'energia, o l'aumento di Entropia, è una conseguenza statisticamente prevedibile dei movimenti e delle collisioni che avvengono a caso tra le molecole. Si considerino ad esempio due contenitori di un gas isolati a diversa temperatura, quando verranno messi a contatto le molecole calde (le più veloci) e le molecole fredde (meno veloci) passeranno a caso da un ambiente all'altro (o meglio scambieranno a caso le loro energie cinetiche durante gli urti in modalità simili a quelle descritte nel moto Browniano) e con il passare del tempo ciò renderà nulla la differenza di temperatura iniziale tra i due scomparti. L'aumento di Entropia che ne consegue è legato ad un aumento di disordine: le molecole veloci e quelle lente inizialmente separate si mescoleranno e l'energia totale del sistema si ripartirà statisticamente in conseguenza delle collisioni che si verificheranno e i due scomparti inizialmente distinguibile per la temperatura diventeranno equivalenti. Prima del mescolamento il sistema avrebbe potuto compiere un lavoro in virtù della differenza di temperatura tra i due scomparti, ma una volta raggiunto l'equilibrio termico nessun lavoro potrà più prodursi.
|
|
|
|
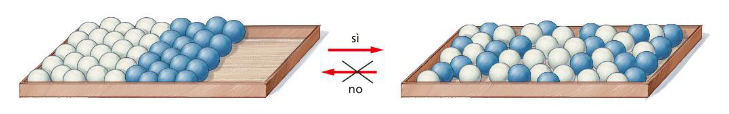
Boltzmann (Ludwig, AU, 1844-1906) suggerì che l’entropia possa anche essere letta come misura del disordine di un sistema e stabilì che: “L’Entropia di uno stato macroscopico S è proporzionale alla probabilità termodinamica di quello stato:” S=kb·ln(Ω)dove kb è la costante di Boltzmann, kb=1,38·10-23J/K quindi secondo Boltzmann un sistema isolato tende sempre a passare da uno stato più ordinato ad uno meno ordinato perchè lo stato meno ordinato ha più probabilità di prodursi l'irreversibilità di una trasformazione termodinamica è connessa all'aumento di entropia del sistema, come anche l'irreversibilità dei processi naturali è legata all'aumento del disordine che qualunque sistema manifesta durante la sua evoluzione. Osservando l'immagine seguente nessuno si aspetta che la disposizione ordinata per colore delle biglie sia stata ottenuta scuotendo la scatola a partire dalla disposizione disordinata
Cosa c'entrano questi bastoncini con la TERMODINAMICA? L'entropia da un punto di vista statistico (Boltzmann) -áL'ENTROPIAásecondoáBoltzmann Capire l’entropia in 7 minuti
|
7. È IMPOSSIBILE tornare indietro nel tempo
Tutte queste scoperte significavano per Clausius, che l’universo, essendo un sistema isolato, stava diventando più caotico e che quindi, tempo prima, dovesse essere stato molto più ordinato, insomma come se Qualcosa o Qualcuno avesse costruito un meccanismo e lo avesse caricato come un orologio a molla che ora pian piano stava perdendo la sua carica ed era destinato a fermarsi... Approfondimenti:
PerchÚ il tempo scorre in una sola direzione? La freccia del tempo e l'entropia Calcoliamo la probabilitÓ che il tempo torni indietro La scienza di TENET -- [Senza spoiler] in quali circostanze, guardando un VIDEO, posso stabilire se questo va avanti o indietro nel tempo?
8. È IMPOSSIBILE che l'universo esista da infinito tempo CLAUSIUS osservò inoltre che: “l’energia dell’universo è costante (l’intero universo può essere considerato un sistema isolato e l’energia in esso contenuta è da sempre la stessa, in accordo con il primo pincipio), ma l’entropia è in aumento” (quindi gli scambi di energia, da cui dipende la vita, non saranno possibili per sempre e dato che la vita esiste tuttora si può concludere che l’universo non esiste da infinito tempo…)
Osservazione: la Che cos'è davvero il big bang (o modello cosmologico standard)? Le tre prove del big bang Il big bang Ŕ davvero l'inizio di tutto? |
|
| 9. ............................ | |
| 10. ........................... |
«La legge secondo cui l'entropia aumenta ha sempre, credo, la posizione suprema tra le leggi della natura. Se qualcuno ti fa notare che la tua teoria dell'universo da compagnia è in disaccordo con le equazioni di Maxwell, allora tanto peggio per le equazioni di Maxwell. Se si scopre che è contraddetto dall'osservazione, beh, questi sperimentatori a volte fanno cose confuse. Ma se la tua teoria è contraria alla Seconda Legge della Termodinamica, non posso darti alcuna speranza; non resta che crollare nella più profonda umiliazione»
Sir Arthur Eddington (UK, 1882-1944)
↑top↑
 ...
...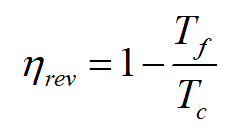
 cfr. la
cfr. la 
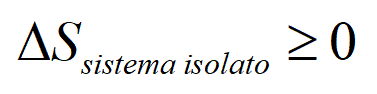
 ...
...
 approfondimento:
approfondimento: 

 ...
...